Comment deux technologies de pointe aident à mieux comprendre les troubles du rythme cardiaque
Après un doctorat à l’institut du thorax et un post-doctorat à New York University aux Etats Unis, Jérôme Montnach a rejoint l’institut du thorax en 2018 dans l’équipe Heart Failure and Pharmacological Approaches dirigée par Michel De Waard. Il a été recruté en tant que Chargé de recherche au CNRS en 2021. Spécialiste en électrophysiologie cardiaque, il met son expertise en patch-clamp au service de la caractérisation fonctionnelle à haut-débit de variants génétiques ainsi qu’à la modulation optique des canaux ioniques.
L’objectif de cette étude est d’utiliser des cardiomyocytes dérivés de cellules souches pluripotentes induites (hiPS-CMs) pour étudier à haut-débit les conséquences électriques de mutations à l’origine de troubles du rythme cardiaque.
Les troubles du rythme cardiaque constituent un enjeu de santé publique majeur en France mais aussi dans le monde entier en touchant plus de 10 milllions de personnes par an en Europe. Ils se manifestent par une contraction anarchique et inefficace du cœur en raison d’anomalies de fonctionnement des canaux ioniques, briques élémentaires de l’activité électrique cardiaque. Ces défauts de fonctionnement des canaux ioniques peuvent soit être d’origine génétique (syndrome de Brugada, syndrome du QT long, …), soit consécutifs à des cardiomyopathies ischémiques ou hypertrophiques par exemple.
Afin de comprendre les mécanismes générateurs d’arythmies, de nombreux travaux ont été réalisés ces dernières années avec l’utilisation de modèles variés mais limités car ne prenant pas en compte la complexité génétique retrouvée chez les patients. En effet, les patients porteurs de variants génétiques possèdent aussi une variabilité génétique qui leur est propre et non reproductible dans des modèles classiques. Etudier les conséquences d’un variant à partir de cellules dérivées du patient et ayant la même complexité génétique constitue donc un vrai plus. Cela est encore plus le cas pour développer des approches thérapeutiques de plus en plus personnalisées.
Depuis une dizaine d’années, ce la rendu possible grâce à la génération de cellules humaines pluripotentes induites (hiPS) issues de cellules du sang ou d’urine de patients. A partir de ces cellules hiPS, il est possible de générer des cardiomyocytes (hiPSC-CMs) dont les propriétés électrophysiologiques sont proches de celles des cardiomyocytes adultes. Ainsi, des cellules hiPS-CMs issues d’un patient atteint de QT long présenteront un allongement de sa durée du potentiel d’action cohérente avec l’allongement de l’intervalle QT sur l’électrocardiogramme du patient.
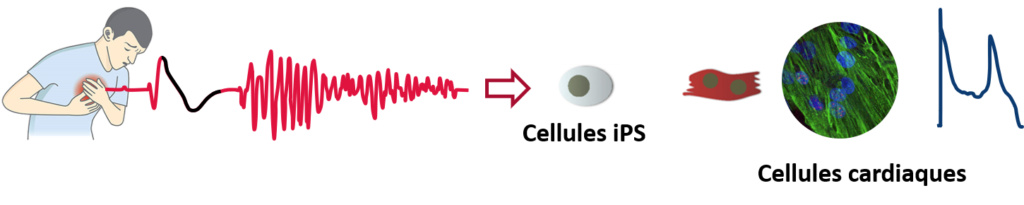
L’utilisation des hiPSC-CMs pour l’étude des canaux ioniques et de leurs anomalies a révolutionné les analyses électrophysiologiques en lien avec la compréhension des troubles du rythme. Dans un objectif de médecine personnalisée, ces cellules permettent aussi, au stade préclinique, de valider et d’invalider certains traitements pharmacologiques. Le patch-clamp constitue la technique de référence pour mener a bien ces études mais son approche à bas-débit est un frein considérable.
Grâce à un co-financement européen FEDER, de la Région Pays de la Loire et de la Fondation Leducq, l’équipe Heart Failure and Pharmacological Approaches, de l’unité de recherche de l’institut du thorax, a fait l’acquisition en 2018 d’un système de patch-clamp haut-débit, permettant l’enregistrement simultané de l’activité électrique de 384 cellules. Cette approche haut-débit implique un redimensionnement de la culture cellulaire mais permet, dans la journée, d’avoir l’équivalent de plusieurs semaines d’expérience en utilisant une approche conventionelle.
Au sein de l’équipe Heart Failure and Pharmacological Approaches, de l’unité de recherche de l’institut du thorax, des programmes de recherche sont développé en lien avec d’une part le groupe du Pr. Patricia Lemarchand de l’équipe Ion Channels and Cardiac Arrhythmias mais aussi avec le groupe de Julien Barc au sein de l’équipe Cardiovascular Genetics avec pour objectifs l’optimisation des conditions expérimentales et la caractérisation des anomalies électriques à partir de cellules hiPS-CMs de patients ou portant la mutation retrouvée chez les patients.
Jérôme a obtenu un financement de la Fondation Genavie en décembre 2019. Il lui a permis de mettre au point les conditions de culture cellulaire mais aussi de mener l’étude électrophysiologique des cardiomyocytes humains dérivés de cellules. Ces travaux se sont focalisés sur l’étude du courant sodique. En effet, ce canal est d’une part de grande amplitude d’autre part l’objet de nombreux projets de recherche au sein de l’institut.
Jérôme ajoute : « Nos travaux se sont déroulés indépendamment des travaux d’un autre laboratoire de pointe sur le sujet et nous sommes arrivés à définir les mêmes conditions expérimentales optimales. Nous sommes donc aujourd’hui très compétitifs sur l’enregistrement de courant sodique sur les hiPS-CMs. Aujourd’hui, fin 2021, nous avons commencé à analyser les premiers variants génétiques en collaboration avec l’équipe Cardiovascular Genetics » . Il conclut « Malgré un contexte sanitaire complexe, le financement de la fondation Genavie nous a permis de devenir compétitifs au niveau international quant à l’analyse électrophysiologique à haut-débit de cardiomyocytes dérivés d’hiPS. Les résultats des premiers variants génétiques sont attendus très prochainement ! » .
Découvrez nos histoires de coeur : des projets scientifiques où le soutien de Genavie a joué un rôle clef :
Décrypter la phosphorylation des canaux sodiques cardiaques : un travail d’orfèvre ! Lauréate de trois financements de la Fondation Genavie, en 2013, 2014 et 2019, Céline nous décrit ici son projet de recherche autour de la phosphorylation du canal sodique cardiaque, qu’elle développe à l’institut au sein d’une équipe de doctorants et d’ingénieurs, et qui réunit aussi plusieurs experts scientifiques internationaux. Découvrir le projet
Gap134 : une arme puissante contre la fibrose et la mort subite cardiaques. Mickaël Derangeon nous présente comment Genavie a permis de comprendre que la Connexine 43 avait un rôle essentiel dans le mécanisme délétère de la fibrose cardiaque, jusqu’à identifier Gap134 comme une molécule inhibant cette même fibrose. Découvrir le projet
Vers une nouvelle approche des canalopathies. La conception d’un médicament prend plus d’une dizaine d’années. Dans les labos de recherche, c’est similaire : des projets visant à mieux comprendre les mécanismes du vivant, les mécanismes d’une maladie et le développement de nouvelles thérapies s’étendent sur une, voire plusieurs décennies. C’est là que Genavie prend tout son sens en permettant des « soudures » entre deux financements. Lire l’article